Kế hoạch bài dạy Hóa học Lớp 8 - Tiết 21: Ôn tập học kì 1 - Năm học 2021-2022 - Trần Mạnh Hùng
Bạn đang xem tài liệu "Kế hoạch bài dạy Hóa học Lớp 8 - Tiết 21: Ôn tập học kì 1 - Năm học 2021-2022 - Trần Mạnh Hùng", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Kế hoạch bài dạy Hóa học Lớp 8 - Tiết 21: Ôn tập học kì 1 - Năm học 2021-2022 - Trần Mạnh Hùng
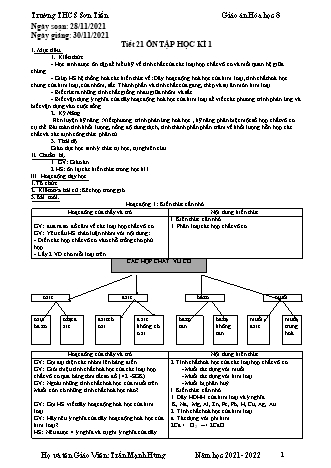
Trường THCS Sơn Tiến Giáo án Hóa học 8 Ngày soạn: 28/11/2021 Ngày giảng: 30/11/2021 Tiết 21 ÔN TẬP HỌC KÌ 1 I. Mục tiêu. 1. Kiến thức - Học sinh được ôn tập để hiểu kỹ về tính chất của các loại hợp chất vô cơ và mối quan hệ giữa chúng. - Giúp HS hệ thống hoá các kiến thức về: Dãy hoạt động hoá học của kim loại, tính chất hoá học chung của kim loại, của nhôm, sắt. Thành phần và tính chất của gang, thép và sự ăn mòn kim loại. - Biết rút ra những tính chất giống nhau giữa nhôm và sắt. - Biết vận dụng ý nghĩa của dãy hoạt động hoá học của kim loại để viết các phương trình phản ứng và biết vận dụng vào cuộc sống. 2. Kỹ Năng Rèn luyện kỹ năng :Viết phương trình phản ứng hoá học , kỹ năng phân biệt một số hợp chất vô cơ cụ thể. Bài toán tính khối lượng, nồng độ dung dịch, tính thành phần phần trăm về khối lượng hỗn hợp các chất và xác định công thức phân tử. 3. Thái độ Giáo dục học sinh ý thức tự học, tự nghiên cứu. II. Chuẩn bị. 1. GV: Giáo án. 2.HS: ôn lại các kiến thức trong học kì I. III. Hoạt động dạy học. 1.Tổ chức 2. Kiểm tra bài cũ: Kết hợp trong giờ 3.Bài mới. Hoạt động 1: Kiến thức cần nhớ. Hoạt đông của thầy và trò Nội dung kiến thức I. Kiến thức cần nhớ GV: đưa ra sơ đồ câm về các loại hợp chất vô cơ. 1. Phân loại các hợp chất vô cơ. GV: Yêu cầu HS thảo luận nhóm với nội dung: - Điền các hợp chất vô cơ vào chỗ trống cho phù hợp. - Lấy 2 VD cho mỗi loại trên. CÁC HỢP CHẤT VÔ CƠ oxit axit bazơ muối oxit oxit a axit có a xit bazơ bazơ muối muối ba zơ xit oxi không có tan không axit trung o xi tan hoà Hoạt đông của thầy và trò Nội dung kiến thức GV: Gọi đại diện các nhóm lên bảng điền. 2.Tính chất hoá học của các loại hợp chất vô cơ. GV: Giới thiệu tính chất hoá học của các loại hợp - Muối tác dụng với muối chất vô cơ qua bảng tóm tắt sơ đồ.( 42 -SGK) - Muối tác dụng với kim loại. GV: Ngoài những tính chất hoá học của muối trên. - Muối bị phân huỷ. Muối còn có những tính chất hoá học nào? I. Kiến thức cần nhớ 1. Dãy HĐHH của kim loại và ý nghĩa GV: Gọi HS viết dãy hoạt động hoá học của kim K, Na, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Au. loại. 2. Tính chất hoá học của kim loại. GV: Hãy nêu ý nghĩa của dãy hoạt động hoá học của a. Tác dụng với phi kim. kim loại? 2Ca + O2 --> 2CaO HS: Nêu được 4 ý nghĩa và tự ghi ý nghĩa của dãy Họ và tên Giáo Viên: Trần Mạnh Hùng Năm học 2021- 2022 1 Trường THCS Sơn Tiến Giáo án Hóa học 8 hoạt động hoá học của kim loại. b. Tác dụng với nước. GV: Hãy nhắc lại tính chất hoá học của kim loại? 2Na + 2H2O -->2 NaOH + H2 Viết phương trình phản ứng cho mỗi tính chất. c. Tác dụng với dung dịch a xit. GV: Gọi đại diện nhóm trình bày. Fe + 2HCl --> FeCl2 + H2 d. Tác dụng với dung dịch muối. Fe + CuCl2 --> FeCl2 + Cu. 2. Tính chất hoá học của kim loại nhôm và sắt có gì giống nhau và khác nhau. - Giống nhau: + Có tính chất hoá học của kim loại. GV: Yêu cầu HS thảo luận nhóm . + Đều không tác dụng với HNO3, H2SO4 đặc nguội. GV: Gọi đại diện nhóm trình bày. - Khác nhau: + Nhôm phản ứng với kiềm, sắt không phản ứng + Trong các hợp chất Al (III), Fe (II, III). Nhôm hoạt động hoá học mạnh hơn sắt. Hợp kim của sắt: Thành phần, tính chất và sản xuất gang, thép. Gang Thép Thành phần GV: Yêu cầu HS thảo luận nhóm và điền nội dung Tính chất vào phiếu học tập. Sản xuất HS: Thảo luận nhóm. 4. Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn. VD: Sắt để ngoài trời lâu ngày bị gỉ. + Những yếu tố ảnh hưởng đến sự ăn mòn kim loại -Các chất trong môi trường mà nó tiếp xúc và nhiệt GV: Hãy lấy VD về sự ăn mòn kim loại? độ ảnh hưởng đến sự ăn mòn kim loại. GV: Những yếu tố nào ảnh hưởng đến sự ăn mòn + Bảo vệ kim loại không bị ăn mòn: kim loại? - Ngăn không cho kim loại tiếp xúc với môi trường và chế tạo những hợp kim ít bị ăn mòn. GV: Làm thế nào để bảo vệ chúng không bị ăn mòn Hoạt động 2: Luyện tập Hoạt đông của thầy và trò Nội dung kiến thức Bài tập: Trình bày phương pháp hoá học để phân II. Bài tập. biết 5 lọ hoá chất bị mất nhãn mà chỉ dùng quỳ tím: - Đánh STT các lọ và lấy mẫu thử. KOH, HCl, H2SO4, Ba(OH)2, KCl. Bước 1: Lấy mỗi lọ 1 giọt nhỏ vào quỳ tím: + Nếu quỳ--> màu xanh: là dd KOH, Ba(OH)2 GV: Gọi đại diện các nhóm trình bày. ( nhóm I ) + Nếu quỳ --> màu đỏ: là dd HCl, H2SO4 ( nhóm II ) + Nếu quỳ không chuyển màu : là KCl. Bước 2: Lấy lần lượt các d d nhóm I nhỏ vào các ống nghiệm có chứa các d d ở nhóm II. - Nếu có kết tủa trắng thì chất ở nhóm I là Ba(OH)2 , chất ở nhóm II là H2SO4 . - Chất còn lại ở nhóm I là : KOH. - Chất còn lại ở nhóm II là: HCl. *PTPƯ:Ba(OH)2+H2SO4-->BaSO4+ H2O Bài tập 2: GV: Gọi HS viết PTPƯ. Bài giải. b. Các chất tác dụng được với: Bài 2: Cho các chất : Mg(OH)2 , CaCO3, K2SO4, 1. Dung dịch HCl là: Mg(OH)2, CaCO3, CuO, HNO3, CuO, NaOH, P2O5. NaOH. a. Gọi tên và phân loại các chất trên. 2. Dung dịch Ba(OH)2 là: K2SO4, HNO3, P2O5. b. Trong các chất trên chất nào tác dụng được với: 3. Dung dịch BaCl2 là: K2SO4. 1. Dung dịch HCl. Bài tập 3. 2. Dung dịch Ba(OH)2 * PTPƯ: Họ và tên Giáo Viên: Trần Mạnh Hùng Năm học 2021- 2022 2 Trường THCS Sơn Tiến Giáo án Hóa học 8 3. Dung dịch BaCl2. Mg + 2HCl --> MgCl2 + H2 (1) GV: Gọi đại diện các nhóm trình bày MgO + 2HCl --> MgCl2 + H2O (2) Bài 3: Hoà tan 9,2 gam hỗn hợp gồm Mg và MgO 1,12 n 0,05(mol) cần vừa đủ m gam dd HCl 14,6%. Sau phản ứng thu H2 22,4 được 1,12lit khí (ở đktc) Theo PT: n n 0,05(mol) a. Tính% về khối lượng mỗi chất trong hỗn hợp ban Mg H2 đầu. mMg = 0,05.24 = 1,2 (g) mMgO = 9,2-1,2=8(g) b. Tính m. 1,2 c. Tính C% của dung dịch thu được sau phản ứng. %mMg .100 13% GV: Gọi HS phân tích đề và nêu hướng giải phần Vậy : 9,2 (a). %mMgO 100 13 87% - Tính nH 2 --> nMg -->mMg nHCl(1) 2nMg 0,1(mol) - Tính mMgO --> Tính % Mg và % MgO GV: gọi HS nêu hướng giải phần (b). 8 nHCl(2) 2nMgO 2. 0,4(mol) - Tính nHCl. 40 -- Tính mHCl b. nHCl(1 2) 0,1 0,4 0,5(mol) - Tính m dd HCl . GV: Gọi HS nêu hướng giải phần (c) mHCl 0,5.36,5 18,25(g) - Sau PƯ có MgCl 2 18,25 - Tính n (1 + 2) --> m MgCl 2 MgCl 2 mdd .100 125(g) - Tính mđ d = mhh + md d HCl - mH 2 14,6 - Tính C% d d MgCl2 Bài tập 1 ( Bài 2 / 69 - SGK) HS: Đọc đề bài. a. 2Al +3 Cl2 --> 2 AlCl3 GV: Yêu cầu HS thảo luận nhóm. b. Al + HNO3 đ, nguội --> không phản ứng. GV: Gọi đại diện nhóm trình bày. c. Fe + H2SO4 đ, nguội --> không phản ứng. d. Fe + Cu(NO3)2 --> Fe(NO3)2 + Cu Bài 2 ( bài 3 /69 SGK) c. B, A, D, C. HS: Đọc đề bài. Bài tập 3 ( Bài 4 / 69 SGK) HS: Thảo luận nhóm. GV: Nhận xét bài làm của các nhóm. a.Al-----> Al2O3---->AlCl3 --->Al(OH)3 ----> Al2O3 -----> Al ------>AlCl3. HS: Thảo luận nhóm. b. FeCl3--> Fe(OH)3--> Fe2O3 --->Fe---> Fe3O4. GV: Gọi đại diện nhóm trình bày. Bài tập 4 (Bài 5 / 69 SGK) 2A + Cl2 --> 2ACl. m Từ công thức : n ta có : M GV: Gọi các nhóm lên Viết phương trình phản ứng. 9,2 23,4 GV: Gọi các nhóm khác nhận xét bổ xung. n ; n A A ACl (A 35,5 Theo PTPƯ ta có : 9,2 23,4 GV: Goi HS viết phương trình phản ứng. nA nACl A (A 35,5) A = 23 Do đó A chính là Na Vậy kim loại hóa trị I đó chính là Na. 4. Củng cố GV chấm một số bài và nhận xét chung. 5 . Dặn dò Chuẩn bị kiểm tra học kì 1 Họ và tên Giáo Viên: Trần Mạnh Hùng Năm học 2021- 2022 3
File đính kèm:
 ke_hoach_bai_day_hoa_hoc_lop_8_tiet_21_on_tap_hoc_ki_1_nam_h.doc
ke_hoach_bai_day_hoa_hoc_lop_8_tiet_21_on_tap_hoc_ki_1_nam_h.doc

